2. 中国科学院大学, 北京 100049;
3. 水利部 黄河水利委员会 黄河上中游管理局, 陕西 西安 710021;
4. 西北农林科技大学 资源环境学院, 陕西 杨凌 712100
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Upper and Middle Yellow River Bureau, Yellow River Conservancy Commission of the Ministry of Water Resources, Xi'an, Shaanxi 710021, China;
4. College of Resources and Environment, Northwest A&F University, Yangling, Shaanxi 712100, China
矿产开发对土壤环境造成了严重破坏,对土壤性质和微生物群落结构的功能和稳定性产生了不利影响,特别是在黄土高原生态脆弱区。对矿区重构土壤进行植被恢复的最终目的是维持矿区生态系统的可持续发展[1]。土壤微生物在生态系统中至关重要,土壤真菌作为土壤微生物的重要组成部分,在改善土壤质量方面具有重要作用[2],探索不同植被恢复条件下土壤真菌群落特征可为生态恢复提供重要信息。土壤真菌作为土壤中的分解者,不仅能够分解土壤中有机物,还能分解植物残体中的木质素和纤维素,对陆地系统碳循环至关重要[3-4],此外,部分真菌在提高植物抗逆性方面发挥着重要功能[5]。植物和微生物产生的酶在土壤养分循环和能量流动中起着重要作用。例如,蔗糖酶、脲酶和碱性磷酸酶与土壤中的碳、氮、磷循环密切相关[6]。酶在许多土壤生态过程中发挥着重要作用,与土壤微生物群落密切相关,可以快速响应植被恢复下微生物群落的变化。
以往对矿区重建土壤的植被恢复效果评价主要集中在土壤质量评价[7]、理化特征[8-9]和植被特征[10]等方面,而对微生物,特别是真菌群落的研究仍然较少。在真菌群落研究方法方面,大多数仍然采用磷脂脂肪酸法(phospholipid fatty acid, PLFA)[11-12],该方法具有一定的局限性,不能全面反映出植被恢复过程中土壤真菌的群落结构和多样性的变化。
近年来,扩增子高通量测序技术的应用极大促进了微生物研究进展,为我们了解环境中微生物状况提供了新的方法。因此,本研究在黄土高原矿区排土场选择3种植被恢复类型(灌木、乔木、草本)及未复垦地的重构土壤,采用扩增子高通量测序技术对土壤真菌群落组成和多样性进行研究。测定土壤理化性质和酶活性,在此基础上探讨植被恢复过程中矿区重构土壤理化性质的变化,以期揭示了土壤理化性质与真菌群落结构和多样性的关系,进一步准确评价植被恢复对黄土高原矿区重构土壤生态的恢复效果。
1 研究区概况与研究方法 1.1 研究区概况本研究在内蒙古自治区准格尔旗东南(北纬39°43′—39°49′,东经111°13′—111°20′)黑岱沟露天煤矿开展。研究区地形为典型的黄土丘陵区,属半干旱、温带大陆性气候。年平均降水量401.6 mm,集中在7—9月,约占年降水量的60%~70%,年蒸发量1 824.7~2 896.1 mm。地带性土壤为以砒砂岩为母岩的栗褐土,矿区土壤为黄土性土壤和风沙土,土壤疏松,抗蚀性差,碱性弱,肥力低。严重的采矿扰动使当地土壤固有的理化和生物特性发生了很大的变化,主要表现在对土壤团聚体的严重破坏、养分的严重流失、地形的变化等方面,因此被认为是一种重构土壤。矿区地带性植被属于暖草原带,植被稀疏,覆盖度低,一般小于30%。主要植被类型有:乔木(北京杨、油松、樟子松、山杏);灌木(欧李、柠条锦鸡儿、丁香、沙棘、紫穗槐)和草本植物(长芒草、沙蒿、达乌里胡枝子、硬质早熟禾、草木犀状黄芪、沙打旺、紫花苜蓿、冰草、拂子茅、阿尔泰狗娃花、狗尾草)[13]。
1.2 研究方法2017年8月下旬选择黑岱沟煤矿北排土场和东排土场进行采样。为了减少由于土壤固有属性引起的变异,采样点选择采用相似地形,同时与矿区工作人员进行沟通,并查阅相关资料,保证了采样点植被恢复年限的基本一致,复垦年限在18~20 a之间。采样地为3种典型植被类型(灌木地、乔木林和草地)和未复垦地。在3种典型植被恢复下各建立了3个采样小区,由于未复垦地面积较小,因此在未复垦地建立了两个采样小区。使用直径5 cm的土钻从每个小区按照S形线路采集5个土样,采样深度为0—20 cm,搅拌均匀,形成一个混合样品。每一个混合样品立即通过一个2 mm的筛子,然后被分成3个部分进行下一步分析。第一部分保存在-80 ℃环境中,用于DNA的提取;第二部分保存在4 ℃环境中,进行酶活性测定;第三部分保留下来,进行试验预处理后的化学性质分析。
(1) 土壤物理性质测定。采用烘干法测定土壤含水量,采用环刀法测定土壤容重。
(2) 土壤化学性质测定。采用水土比1:1电极法测定pH值,采用重铬酸钾容量法测定有机质,采用碱解扩散法测定速效氮,采用Olsen法测定速效磷[14]。
(3) 土壤酶活性测定。采用高锰酸钾滴定法测定过氧化氢酶,采用苯磷酸二钠比色法测定碱性磷酸酶,采用靛酚蓝光度法测定脲酶,3, 5-二硝基水杨酸比色法测定蔗糖酶[15]。
(4) 土壤真菌群落多样性测定。取0.25 g左右新鲜土壤样品,按照PowerSoilkit (MOBIOLaboratories, Carlsbad, USA)试剂盒的方法提取土壤DNA,随后对样本进行ITS1区域的扩增,引物为:1743F-5’-CTTGGTCATTTAGAGGAAGTAA-3’和2043R-5’-GCTGCGTTCTTCATCGATGC-3’。扩增完毕后建立样本原始文库,采用北京百迈客生物科技有限公司Illumina Hiseq 2500平台(Illumina Corporation, USA),2×250 bp的双端测序策略对文库进行测序。使用Trimmomatic软件(version on0.33)对原始序列进行质控并去除嵌合体。采用软件Mothur软件将相似性大于97%的序列归为同一种可操作分类单元(operational taxonomic units, OTUs),对每个OTU的代表序列做物种注释,得到对应的物种信息[2, 5]。
1.3 数据处理首先采用Microsoft Excel 2015进行数据处理,应用SPSS22.0对数据进行方差分析、相关性分析和逐步回归分析,R语言Vegan程序包进行主坐标分析、冗余分析和Adonis分析,Microsoft Excel 2015绘制柱状图。
2 结果与分析 2.1 不同植被类型下土壤理化性质及酶活性变化不同植被类型下土壤理化性质及酶活性的结果如表 1所示。研究区域土壤偏碱性,养分含量较低。含水量、有机质、速效磷、脲酶以及蔗糖酶在不同植被类型下差异显著(p < 0.05),容重、pH值、速效氮、过氧化氢酶以及碱性磷酸酶在不同植被类型下均未呈现出显著差异。灌木林、乔木林和草地3种植被类型下土壤含水量显著高于未复垦地含水量(p < 0.05),草地土壤含水量最高,为8.85%。灌木林土壤具有最高的有机质(15.85 g/kg)、速效氮(8.98 mg/kg)、速效磷(8.11 mg/kg)、碱性磷酸酶〔0.45 mg/(g·24 h)〕、脲酶〔0.87 mg/(g·24 h)〕以及蔗糖酶〔3.28 mg/(g·24 h)〕含量。未复垦地有机质(5.22 g/kg)、速效氮(7.46 mg/kg)、速效磷(1.91 mg/kg)、过氧化氢酶〔3.49 mg/(g·24 h)〕、碱性磷酸酶〔0.18 mg/(g·24 h)〕、脲酶〔0.10 mg/(g·24 h)〕以及蔗糖酶〔0.68 mg/(g·24 h)〕均为最低。然而,容重和pH值均在未复垦地土壤中最高,分别为1.33 g/cm3和8.76。
|
|
表 1 黄土高原矿区不同植被恢复下土壤理化性质和酶活性 |
不同植被类型下土壤真菌群落丰富度和多样性指数如表 2所示。不同植被恢复下土壤真菌丰富度指数(ACE估计量和Chao1指数)和多样性指数(Shannon指数)差异极显著(p < 0.01)。所有样本覆盖度均在99%以上,说明测序结果可靠,反映了土壤真菌群落的真实情况。灌木地、乔木林以及草地3种植被类型恢复下土壤真菌OTU、群落丰富度和多样性均与未复垦地差异极显著(p < 0.01),且未复垦地土壤真菌OTU,ACE估计量、Chao1指数和Shannon指数均为最低。这些结果表明植被恢复显著提高了真菌群落丰富度和多样性。
|
|
表 2 黄土高原矿区不同植被恢复下土壤真菌群落丰富度和多样性指数 |
不同植被恢复下土壤真菌在门水平上的群落结构如图 1所示。4个样地主要包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、球囊菌门(Glomeromycota)、被孢霉门(Mortierellomycota)、壶菌门(Chytridiomycota)、丝足虫类(Cercozoa)、梳霉门(Kickxellomycota)、油壶菌门(Olpidiomycota)。其中以子囊菌门、担子菌门和球囊菌门为主要真菌类群,3种主要真菌类群相对丰度总和在各样地所占比重均超过50%。不同样地中各个真菌门相对丰度所占比例不同,子囊菌门和担子菌门均在未复垦地中最高,分别约为64%和29%;球囊菌门在草地中最高,约为11%。子囊菌门在4个样地中相对丰度排序为:未复垦地>灌木地>乔木林>草地;担子菌门相对丰度排序为:未复垦地>乔木林>灌木地>草地;球囊菌门相对丰度排序为:草地>乔木林>灌木地>未复垦地。其中,担子菌门,球囊菌门以及无法识别菌门的相对丰度在4个样地之间差异显著(p < 0.05)。

|
图 1 黄土高原矿区不同植被恢复下土壤门分类水平真菌群落结构特征 |
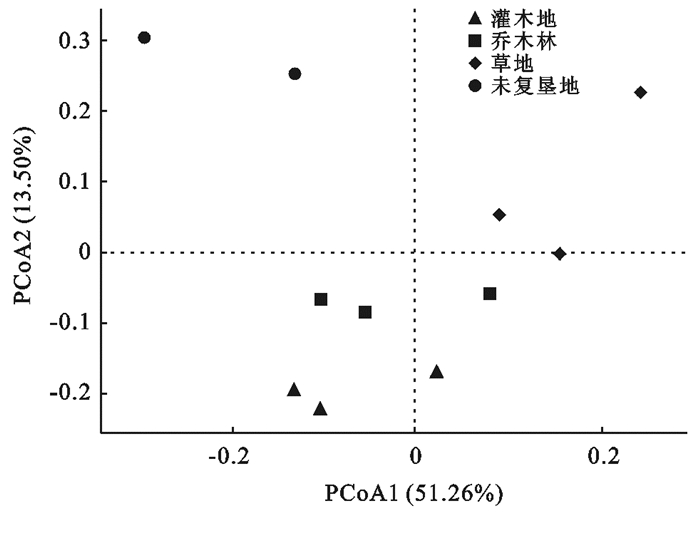
由表 3及图 2可以看出,3种植被类型之间土壤真菌群落结构差异较小,未复垦地土壤真菌群落与3种植被类型之间的差异大于3种植被类型两两之间的组间差异。总体上,4个样地两两组间差异并不显著,土壤真菌群落结构的变化在4个样地间相对稳定。
|
|
表 3 黄土高原矿区不同样地之间土壤群落结构Adonis分析 |
|
图 2 黄土高原矿区不同植被恢复下土壤真菌群落主坐标分析 |
从研究区的土壤理化性质、酶活性与真菌群落多样性相关性分析结果(详见表 4)可知,土壤含水量与OUT,ACE估计量和Chao1指数均呈显著正相关,相关系数分别为0.701,0.697和0.710,与Shannon指数呈极显著正相关,相关系数为0.747;土壤速效磷与ACE估计量和Chao1指数呈显著正相关,相关系数分别为0.608和0.619;土壤脲酶与OTU,ACE估计量和Chao1指数均呈显著正相关,相关系数分别为0.676,0.704和0.709;土壤蔗糖酶与OTU,ACE估计量,Chao1指数和Shannon指数呈显著正相关,相关系数分别为0.712,0.693,0.697和0.690。其余土壤理化性质与真菌群落多样性之间没有表现出显著相关性。
|
|
表 4 黄土高原矿区土壤理化性质、酶活性与真菌群落多样性相关性分析 |
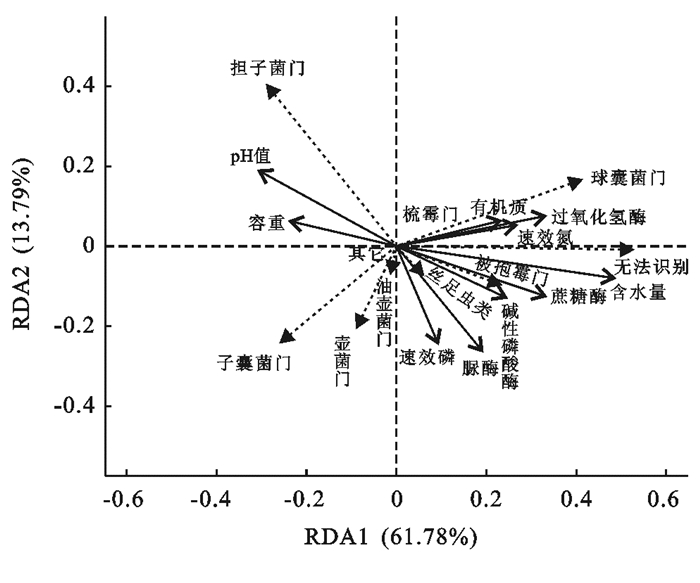
门水平上土壤理化性质、酶活性与土壤真菌群落结构的冗余分析(RDA)如图 3所示。RDA分析结果中,真菌群落差异在第一和第二排序轴上的解释率分别是61.78%和13.79%,土壤理化性质和酶活性箭头的连线长度以及土壤理化性质、酶活性箭头与真菌物种之间箭头夹角可以看出土壤理化性质、酶活性对真菌群落的影响[16],除了担子菌门,真菌群落主要分布在第一、三、四象限。担子菌门与pH值和容重呈正相关,与其他土壤理化性质和酶活性呈负相关;子囊菌门除与有机质、过氧化氢酶、速效氮和含水量呈负相关外,与其他土壤理化性质、酶活性之间相关性不明显;球囊菌门与pH值和容重呈负相关,与速效磷相关性不明显,与其他土壤理化性质和酶活性呈正相关。
|
图 3 黄土高原矿区门水平土壤真菌群落结构与土壤性质的冗余分析(redundancy analysis, RDA) |
通过土壤真菌群落多样性与土壤理化性质进行逐步回归分析,结果得出土壤真菌OTU,ACE估计量,Chao1指数以及Shannon指数的最大影响因素为土壤含水量,回归方程和R2如表 5所示。
|
|
表 5 黄土高原矿区土壤真菌群落多样性与土壤理化性质逐步回归分析 |
对矿区重构土壤进行植被恢复有效改善和提高了土壤理化性质、酶活性和真菌群落多样性。与之前的研究结果类似,植被恢复在促进和恢复脆弱地区生态环境方面发挥着重要作用,特别是在黄土高原矿区[17];Yang等[18]发现在干旱地区复垦可以显著提高土壤养分含量;王雅等[16]通过研究黄土高原不同植被类型对土壤理化性质及酶活性的影响发现,不同植被类型对土壤养分及酶活性的影响具有显著差异。本研究中,不同植被类型导致了土壤理化性质和酶活性的差异。如表 1所示,灌木地土壤在大多数土壤性质和酶活性上要优于其他3个样地。在一系列生化过程的影响下,干旱半干旱地区灌木土壤通常具有较高的土壤养分含量,这种现象被称为“沃岛效应”[19-20]。土壤养分的有效性与土壤酶活性密切相关,土壤酶活性直接对土壤养分矿化产生影响,植被恢复通过改变酶活性和养分转化率从而改变了生态资源的有效性[18]。
3.2 不同植被类型下土壤真菌群落多样性如表 2所示,不同植被恢复类型对真菌OTU、群落丰富度(ACE估计量和Chao1指数)和多样性(Shannon指数)指标均有显著影响(p < 0.01)。一般来说,土壤含水量是影响微生物群落丰富度的重要因素[20],由于未复垦地土壤含水量显著低于其他3种植被类型下土壤含水量(p < 0.01),导致真菌群落丰富度和多样性显著低于3种植被类型。从图 1可以看出黄土高原矿区重构土壤真菌主要门类为子囊菌门、担子菌门和球囊菌门,这与黄土高原梯田土壤[21]、云南茶园酸性土壤[22]以及黄河三角洲地区油泥污染土壤[23]中真菌主要门类相似,说明以上几种真菌门类在土壤中广泛存在,并不是该研究区域特有的。未复垦地子囊菌门和担子菌门相对丰度高于其他3种植被类型土壤,有研究对全世界真菌种类进行了估计,被正式描述的不足10%[24],因此,对未识别真菌种类的深入研究具有重要意义,相比于未复垦地,3种植被恢复下土壤无法识别真菌相对丰度增加(p < 0.05),真菌种类的增加导致了物种之间能量和营养的竞争加剧,使得主要门类真菌相对丰度的降低,也进一步说明了植被恢复丰富了土壤真菌的群落结构。尽管植被恢复对土壤真菌群落结构产生了一定影响,土壤真菌群落结构在4个样地之间仍然保持了一定稳定性(表 3),说明矿区重构土壤真菌群落的生态恢复是一个漫长的过程。
3.3 土壤理化性质以及酶活性和真菌群落的关系土壤性质的差异会导致土壤微生物群落产生一定程度的差别。Lauber等[25]认为不同植被土壤主要真菌门类相对丰度的不同是由于土壤有机质、氮素等养分状况的不同而导致的,土壤真菌群落结构变化受到土壤养分状况的影响。RDA结果(图 3)表明,土壤含水量和pH值为影响真菌群落结构的主要因素。有研究表明,含水量的增加有利于提高微生物的养分利用率,从而影响微生物群落[26]。pH值能够影响土壤中化合物形态,进而影响土壤微生物对养分的吸收利用,最终影响土壤真菌群落[5]。巨天珍等[27]以天水小陇山红豆杉林土壤为研究对象,发现真菌总数与水分呈显著正相关,而与pH值呈显著负相关。郑智[28]以浙江滨海盐碱土为研究对象,发现土壤水分和pH值的变化均能显著影响真菌多样性。本研究区气候干旱,土壤含水量是影响真菌群落结构的最主要因素。真菌对于不同土壤pH值的适应范围不同,大多为5~8之间[5],本研究中pH值均在8以上,一定程度上限制了土壤真菌的生长发育,因此与大多数真菌门类呈负相关。土壤酶活性总体上与真菌群落呈正相关,这是由于微生物群落与酶活性的高度自相关性,土壤养分含量的增加促进了微生物数量的增加从而促进了微生物分泌的酶增加。资源的异质性有助于维持微生物的高度多样性和共存。一般来说,植被通过凋落物分解和根系分泌等多种因素为土壤微生物群落提供了资源异质性。因此,植被恢复对于提高微生物多样性具有重要作用;此外,对植被恢复的人为管理养护,例如养分的施用,也增加了土壤微生物资源的异质性[29]。
本研究结果有助于对植被恢复效果有一个大致了解,但由于研究区域的特定性以及土壤微生物群落的复杂性,今后需在不同地区和土壤类型下开展相关研究,进一步探讨土壤、植被和微生物之间的关系。
4 结论(1) 与未复垦地相比,经过18~20 a的植被恢复,3种典型植被类型均显著改善了土壤含水量、有机质、速效氮、速效磷含量以及酶活性,而对容重和pH值的改善不显著。
(2) 与未复垦地相比,经过18~20 a的植被恢复,3种典型植被类型均显著提高了真菌群落多样性,灌木地土壤具有最佳的土壤真菌多样性,而4个样地之间土壤真菌群落结构保持了一定的稳定性,植被恢复不足以显著影响土壤真菌群落结构。
(3) 土壤含水量是影响土壤真菌群落多样性的最重要因素,种植灌木对黄土高原矿区重构土壤生态恢复效果最好。
| [1] |
Li Pengfei, Zhang Xingchang, Hao Mingde, et al. Effects of vegetation restoration on soil bacterial communities, enzyme activities, and nutrients of reconstructed soil in a mining area on the Loess Plateau, China[J]. Sustainability, 2019, 11(8): 2295-2310. DOI:10.3390/su11082295 |
| [2] |
肖礼, 黄懿梅, 赵俊峰, 等. 土壤真菌组成对黄土高原梯田种植类型的响应[J]. 中国环境科学, 2017, 37(8): 3151-3158. DOI:10.3969/j.issn.1000-6923.2017.08.041 |
| [3] |
Barbi F, Prudent E, Vallon L, et al. Tree species select diverse soil fungal communities expressing different sets of lignocellulolytic enzyme-encoding genes[J]. Soil Biology and Biochemistry, 2016, 100: 149-159. DOI:10.1016/j.soilbio.2016.06.008 |
| [4] |
Cui Yongxing, Bing Haijian, Fang Linchuan, et al. Diversity patterns of the rhizosphere and bulk soil microbial communities along an altitudinal gradient in an alpine ecosystem of the Eastern Tibetan Plateau[J]. Geoderma, 2019, 338: 118-127. DOI:10.1016/j.geoderma.2018.11.047 |
| [5] |
张树萌, 黄懿梅, 倪银霞, 等. 宁南山区人工林草对土壤真菌群落的影响[J]. 中国环境科学, 2018, 38(4): 1449-1458. |
| [6] |
Burke D J, Weintraub M N, Hewins C R, et al. Relationship between soil enzyme activities, nutrient cycling and soil fungal communities in a northern hardwood forest[J]. Soil Biology and Biochemistry, 2011, 43(4): 795-803. DOI:10.1016/j.soilbio.2010.12.014 |
| [7] |
Masto R E, Sheik S, Nehru G, et al. Assessment of environmental soil quality around Sonepur Bazari mine of Raniganj coalfield, India[J]. Solid Earth, 2015, 6(3): 811-821. DOI:10.5194/se-6-811-2015 |
| [8] |
Liu Xiaoyang, Bai Zhongke, Zhou Wei, et al. Changes in soil properties in the soil profile after mining and reclamation in an opencast coal mine on the Loess Plateau, China[J]. Ecological Engineering, 2017, 98: 228-239. DOI:10.1016/j.ecoleng.2016.10.078 |
| [9] |
Zhou Wei, Yang Ke, Bai Zhongke, et al. The development of topsoil properties under different reclaimed land uses in the Pingshuo opencast coalmine of Loess Plateau of China[J]. Ecological Engineering, 2017, 100: 237-245. DOI:10.1016/j.ecoleng.2016.12.028 |
| [10] |
Huang Lei, Zhang Peng, Hu Yigang, et al. Vegetation and soil restoration in refuse dumps from open pit coal mines[J]. Ecological Engineering, 2016, 94: 638-646. DOI:10.1016/j.ecoleng.2016.06.108 |
| [11] |
胡婵娟, 郭雷, 刘国华. 黄土丘陵沟壑区不同植被恢复格局下土壤微生物群落结构[J]. 生态学报, 2014, 34(11): 2986-2995. |
| [12] |
刘海燕, 魏天兴, 王仙. 黄土丘陵区人工林土壤微生物PLFA标记多样性分析[J]. 北京林业大学学报, 2016, 38(1): 28-35. |
| [13] |
张鹏, 赵洋, 黄磊, 等. 植被重建对露天煤矿排土场土壤酶活性的影响[J]. 生态学报, 2016, 36(9): 2715-2723. |
| [14] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000.
|
| [15] |
关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986.
|
| [16] |
王雅, 刘爽, 郭晋丽, 等. 黄土高原不同植被类型对土壤养分、酶活性及微生物的影响[J]. 水土保持通报, 2018, 38(1): 62-68. |
| [17] |
Wang Jinman, Wang Hongdan, Cao Yingui, et al. Effects of soil and topographic factors on vegetation restoration in opencast coal mine dumps located in a loess area[J]. Scientific Reports, 2016, 6: 22058. DOI:10.1038/srep22058 |
| [18] |
Yang Haichang, Zhang Fenghua, Chen Yun, et al. Assessment of reclamation treatments of abandoned farmland in an arid region of China[J]. Sustainability, 2016, 8(11): 1183. DOI:10.3390/su8111183 |
| [19] |
Reynolds J F, Virginia R A, Kemp P R, et al. Impact of drought on desert shrubs:Effects of seasonality and degree of resource island development[J]. Ecological Monographs, 1999, 69(1): 69-106. DOI:10.1890/0012-9615(1999)069[0069:IODODS]2.0.CO;2 |
| [20] |
Ridolfi L, Laio F, d'Odorico P. Fertility island formation and evolution in dryland ecosystems[J]. Ecology and Society, 2008, 13(1): 5-12. DOI:10.5751/ES-02302-130105 |
| [21] |
Buckley D H, Schmidt T M. The structure of microbial communities in soil and the lasting impact of cultivation[J]. Microbial Ecology, 2001, 42(1): 11-21. |
| [22] |
季凌飞, 倪康, 马立锋, 等. 不同施肥方式对酸性茶园土壤真菌群落的影响[J]. 生态学报, 2018, 38(22): 8158-8166. |
| [23] |
Wang Huihui, Kuang Shaoping, Lang Qiaolin, et al. Effects of aged oil sludge on soil physicochemical properties and fungal diversity revealed by high-throughput sequencing analysis[J]. Archaea, 2018, 1(4): 1-8. |
| [24] |
Hawksworth D L, Rossman A Y. Where are all the undescribed fungi?[J]. Phytopathology, 1997, 87(9): 888-891. DOI:10.1094/PHYTO.1997.87.9.888 |
| [25] |
Lauber C L, Strickland M S, Bradford M A, et al. The influence of soil properties on the structure of bacterial and fungal communities across land-use types[J]. Soil Biology and Biochemistry, 2008, 40(9): 2407-2415. DOI:10.1016/j.soilbio.2008.05.021 |
| [26] |
王杰, 李刚, 修伟明, 等. 贝加尔针茅草原土壤微生物功能多样性对氮素和水分添加的响应[J]. 草业学报, 2014, 23(4): 343-350. |
| [27] |
巨天珍, 陈源, 常成虎, 等. 天水小陇山红豆杉﹝(Taxus chinensis(Pilg.) Rehd﹞林土壤真菌多样性及其与生态因子的相关性[J]. 环境科学研究, 2008, 21(1): 128-132. |
| [28] |
郑智.水分、pH和秸秆对滨海盐土微生物多样性和PLFA组成影响[D].杭州: 浙江农林大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-10341-1015504768.htm
|
| [29] |
Saleem M, Pervaiz Z H, Traw M B. Theories, mechanisms and patterns of microbiome species coexistence in an era of climate change[M]//SpringerBriefs in Ecology. Cham: Springer International Publishing, 2015: 13-53.
|
 2019, Vol. 39
2019, Vol. 39 

